da https://www.jasco-global.com/principle/1-what-is-raman-spectroscopy/#Raman
Effetto Raman e spettroscopia Raman
La spettroscopia Raman è una tecnica di indagine della struttura molecolare, considerata complementare alla spettroscopia a infrarossi. Si basa sull'effetto Raman,che venne identificato per la prima volta dal fisico indiano Chandrasekhara Venkata Raman, nel 1928. L'effetto Raman si basa sulla diffusione della luce, che include sia la dispersione elastica (Rayleigh) alla stessa lunghezza d'onda della luce incidente, che la diffusione anelastica (Raman) a diverse lunghezze d'onda, a causa delle vibrazioni molecolari. Lo scattering Raman è circa un milione di volte meno intenso dello scattering Rayleigh. Pertanto, per ottenere gli spettri Raman, è necessario impedire che lo scattering di Rayleigh prevalga sullo scattering Raman.
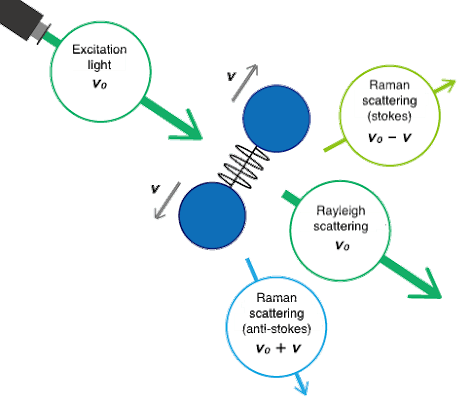
Fig. 1 Vibrazioni molecolari e scattering Raman
Gli spettri Raman vengono misurati eccitando un campione utilizzando un raggio laser ad alta intensità, con la luce diffusa risultante che viene fatta passare attraverso uno spettrometro. Lo spostamento Raman è la differenza di energia tra la luce incidente e la luce diffusa. Nello spettro risultante, l'asse verticale è l'intensità della luce diffusa e l'asse orizzontale è il numero d'onda dello spostamento Raman (cm -1 ).
Qual è il range energetico associato all'effetto Raman?
Lo spostamento Raman è associato a due diverse bande di energia. Lo spostamento a lunghezze d'onda superiori a quella della luce incidente è chiamato scattering di Stokes. Lo spostamento a lunghezze d'onda inferiori a quella della luce incidente è chiamato scattering anti-Stokes. Ad esempio, lo spettro Raman dello zolfo misurato con una lunghezza d'onda di eccitazione di 532 nm (laser verde) è mostrato in Fig. 2. Lo scattering di Stokes è osservato nella regione del numero d'onda inferiore (lunghezza d'onda più lunga) e lo scattering anti-Stokes nel numero d'onda più alto (lunghezza d'onda più corta). In genere, per l'analisi vengono utilizzati picchi di scattering Stokes a intensità più elevata, ma possono essere utilizzati anche picchi anti-Stokes.
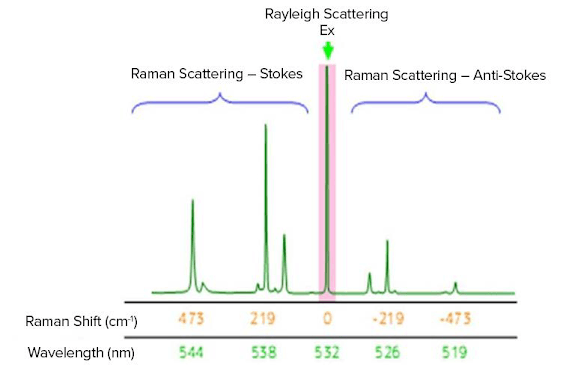
Fig. 2 Spettro Raman dello zolfo
Differenza tra spettroscopia Raman e spettroscopia IR
Sia la spettroscopia Raman che la spettroscopia IR si basano su vibrazioni molecolari. La spettroscopia a infrarossi si basa sull'assorbimento dell'energia luminosa corrispondente all'energia vibrazionale delle molecole. La spettroscopia Raman si basa sulla diffusione della luce incidente a un'energia spostata dall'energia vibrazionale ( hν ) della molecola. Le modalità di vibrazione per gli stessi gruppi funzionali sono osservate allo stesso numero d'onda.
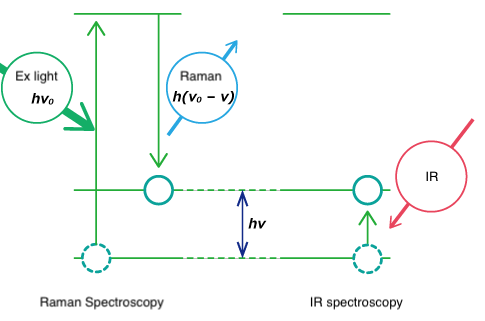
Fig. 3 Livello di energia di vibrazione
Sebbene entrambe siano forme di spettroscopia vibrazionale, la spettroscopia IR e Raman differiscono per alcuni aspetti fondamentali, come mostrato in Fig. 4. La spettroscopia IR si basa sul fatto che l'assorbimento molecolare a frequenze vibrazionali specifiche provoca un cambiamento nel momento di dipolo. La spettroscopia Raman si basa sul cambiamento nella polarizzabilità di una molecola alle frequenze (spostamento Raman) a cui la molecola disperde la radiazione. La spettroscopia IR è sensibile alle vibrazioni dei gruppi funzionali eteronucleari e ai legami polari, in particolare l'OH che si allunga in acqua. La spettroscopia Raman è sensibile ai legami molecolari omonucleari come i legami CC, C=C e C≡C.
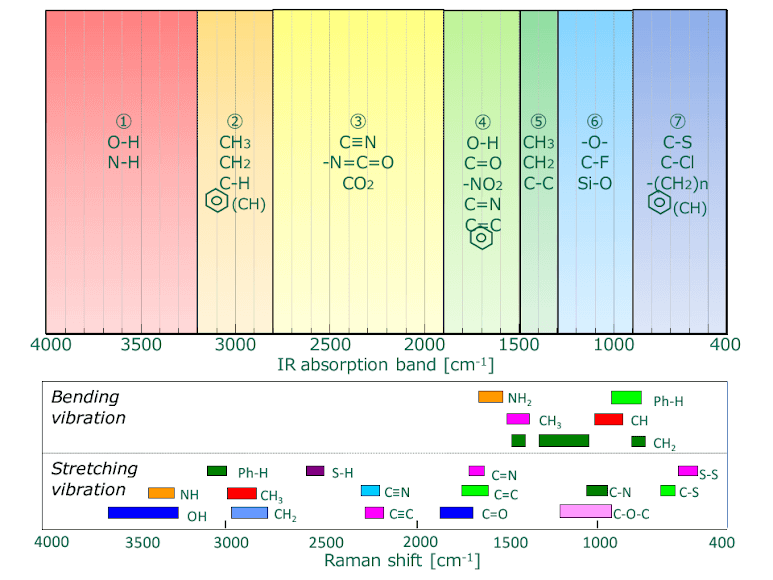
Fig. 4 Bande di assorbimento IR (superiore) vs. spostamento Raman (inferiore) per gruppi funzionali
Un confronto tra la trasmissione IR e gli spettri Raman per L-cistina è mostrato in Fig. 5. L'intensità dei due spettri mostra una simmetria speculare, quindi gli spettri IR e Raman sono spesso considerati "complementari". Ma sono diversi nel tipo di fenomeno fisico che possono misurare. Nelle misurazioni IR, l'intensità spettrale dipende dalla dimensione del momento di dipolo per le modalità di vibrazione per legami come C=O e OH. D'altra parte, nella spettroscopia Raman, l'intensità dipende dal grado di polarizzabilità (volume di elettroni) per le modalità di vibrazione per legami come SS, CC e CN.
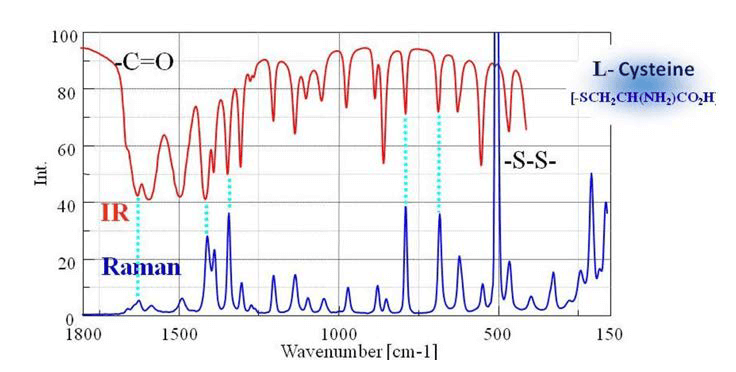
Fig. 5 Confronto degli spettri IR e Raman